Для того чтоб полюбоваться всамделишными бактериями и микроскопическими грибами не нужен даже микроскоп, хотя и лишним он не будет. Но для начала бактерии и грибы нужно вырастить.
Для этого приготовим питательную среду. Питательные среды бывают жидкими, их зовут бульон, и твердыми. Мы будем готовить твердую, потому что на ней можно видеть колонии бактерий невооруженным глазом. Выращивать бактерий на твердой среде придумал Кох, когда ему потребовалось изолировать колонию бактерий одного вида. До этого использовали жидкий бульон, где все бактерии перемешивались. Но если в бульон добавить немного гелеобразующего вещества, например, желатина или агар-агара (добываемого из водорослей), на полученном желе хорошо растут колонии микроорганизмов. Итак, готовим желе. Теплую воду разводим с желатином и подогреваем на водяной бане, добавляем растворенные в воде питательные вещества. Если у вас нет специальной питательной смеси, попросите маму дать вам немного куриного бульона.

Остывший, но не затвердевший(!) кисель разливаем по чашкам петри. В чашки, в которых мы хотим видеть грибы, капнем капельку уксуса. Это замедлит рост бактерий, а грибы и бактерии, как известно, конкуренты. Пометим фломиком чашки с уксусом.

Теперь поставим чашки в холодильник. Когда среда затвердеет, достанем их и заселим микробами. Вариантов много. Можно взять их с внутренней стороны собственной щеки или с пальцев, из почвы комнатных растений, с ободка унитаза. Грибы тоже любят почву или черствый хлеб. Красивая плесень растет на чайной заварке.
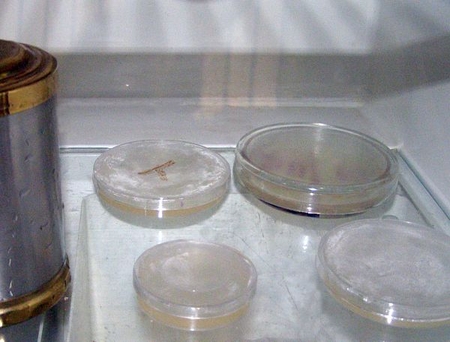
Теперь осталось только положить чашки на книжную полку и ждать несколько дней.

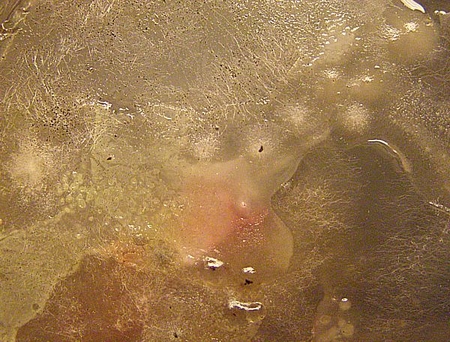
Теперь можно смотреть и зарисовывать.

(устаревшее название агар-агар) – продукт, получаемый из красных и бурых водорослей (таких как Eucheuma spinosum Ag., E. gelatinae Ag., Gelidium cartilagineum (Grev. и др.) и образующий в водных растворах плотный студень. Представляет собой белый, похожий на муку порошок.
Состоит в основном из полисахаридов. Применяется в составе питательных сред для культивирования бактерий, грибов, водорослей, а также в кондитерской промышленности, при производстве желейного мармелада, желе, пудингов, мясных и рыбных студней, и т.д.
Биологический (лабораторный) агар
отличается от пищевого более высоким качеством, стоимость пищевого
агара при этом намного ниже. При использовании в домашних условиях,
качество агара является не столь значимым, поэтому есть смысл, брать
именно агар используемый в кондитерской промышленности.
Пищевой
агар разделяется по плотности, например: Агар М 500, Агар G 700, Агар
–900, и т.д. Чем больше число в названии, тем большей вязкостью /
плотностью будет обладать полученный гель / студень. Пропорционально
увеличению плотности, уменьшается расход агара, но при этом
увеличивается его цена.
Если плотность агара неизвестна, его расход можно подобрать экспериментальным путем, получив среду напоминающую по консистенции мармелад. Если среда будет слишком мягкая, Вам будет неудобно переносить отрезанные кусочки.
Найти где продается агар, можно на сайте журнала товары и цены, набрав слово "агар" в строке поиска.
Для выращивания мицелия высших базидиомицетов используются различные питательные среды на агаровой основе. В зависимости от выращиваемого вида, а так же от поставленных целей, питательные среды могут различаться по составу, уровню Ph, вязкости и т.д.
Не будем подробно останавливаться на приготовлении сложных агаровых сред, кому интересен этот вопрос, без труда сможет отыскать необходимую информацию в соответствующей литературе. Рассмотрим приготовление двух самых простых, и в тоже время, подходящих для выращивания огромного количества видов грибов, питательных средах - среды на зерновом, и среды на картофельном отваре.
Питательная среда из зернового отвара
Состав: Зерновой отвар* -100 мл**; агар - 1,5 г.***
* Можно использовать отвар, который остается у Вас после приготовления зерна (если Вы используете зерно в качестве субстрата), но только если зерно варилось без добавления Н2О2. В противном случае, агар попросту не застынет.
**Расход среды на одну 100 мм чашку Петри ~ 30-50 мл.
*** При использовании девятисотого агара.
Процедура приготовления
Берем около 100 мл зерна (пшеница, рожь, ячмень, овес и т.д.), высыпаем в емкость, заливаем 500 мл воды (используется обычная вода из-под крана),
ставим на газ,

доводим до кипения,


За это время часть воды выкипит, а оставшаяся часть окрасится в приятный, темно-коричневый цвет.

Получившийся отвар необходимо профильтровать. В качестве фильтра можно использовать сложенную в несколько слоев марлю, или хлопчатобумажную ткань. Их укладывают в сито или воронку и аккуратно выливают отвар.

Зерно и мелкие частицы, оставшиеся на фильтре выбрасывают.

Если количество отвара получилось меньше, чем Вы рассчитывали, доведите его до нужного объема долив необходимое количество воды (используется обычная вода из-под крана).

Получившийся отвар переливаем в небольшую емкость,

ставим на газ, доводим до кипения и уменьшаем огонь.

Добавляем необходимое количество агара, постепенно* высыпая его в кипящий отвар. *(Если агар высыпать сразу, он слипнется в комок, который будет потом очень нелегко растворить в жидкости).

Размешивая, снова доводим отвар до кипения.

Продолжая постоянно помешивать, добиваемся ПОЛНОГО растворения агара. Как только это произойдет - среда готова.

После приготовления, тут же разливаем готовую среду по чашкам Петри. (Чашки Петри сделаны из закаленного стекла, поэтому они не лопнут.)

Наливать среду, следует слоем 3-5 мм.
![]()
После этого накрываем чашки Петри,

и установив их одна на другую в какую-нибудь тарелку или блюдце, (так будет удобнее переносить их с места на место),

ставим в скороварку (или кастрюлю),

и стерилизуем в течение 1 часа.

Питательная среда из картофельного отвара
Состав:
Картофельный отвар -100 мл; агар - 1,5 г.
Процедура приготовления
Берем 150 г картофеля,

тщательно отмываем его от земли,

не очищая, нарезаем кубиками ~1х1 см,

высыпаем в емкость,

заливаем 500 мл воды (используется обычная вода из-под крана),

ставим на газ,

доводим до кипения,

делаем маленький огонек, и варим в течение 30 минут.

За это время часть воды выкипит, а оставшаяся часть окрасится в светло-желтый цвет.
Полученный отвар, так же необходимо профильтровать.

С готовым отваром, поступаем точно так же, как и в предыдущем случае.

Изготовление инокуляционной петли
Берем самую длинную, какую сможем найти иглу (замечательно подходит "набор игл для шитья кукол"),

нагреваем докрасна,

и не очень сильно , расплющиваем молотком 1-2 см ее острия.

Должно получиться что-то подобное.

Зажав самый кончик иглы (5-7 мм) в тисках, загибаем его под прямым углом (буквой "Г"),

и слегка приплющиваем по бокам.*

*Это делается это для того, чтобы обеспечить лучший контакт инокуляционной петли при соприкосновении с поверхностью.

Теперь делаем ручку - оборачиваем противоположенный конец иглы изолентой.

В результате получается вот такая, (очень удобная для работы со спорами) инокуляционная петля.

Инокуляция
Аккуратно, стараясь не сдвигать крышки
, вынимаем чашки Петри из остывшей скороварки, и откачиваем шприцем воду скопившеюся в блюдце.
Конденсат образовавшийся внутри, на крышках чашек Петри, опасности не представляет.

Работы по проведению инокуляции, должны проводиться в стерильных условиях! Для этого, все необходимые инструменты (инокуляционную петлю, скальпель, вату, спирт, горелку и т.д.), а так же приготовленные чашки Петри, переносят в помещение, которое затем, в течение некоторого времени* обрабатывают бактерицидной лампой.
*(30-60 мин., зависит от площади помещения и мощности лампы.)
Зайдя в помещение, расставляем инструменты так, чтобы нам было удобно работать. Протираем спиртом все поверхности.
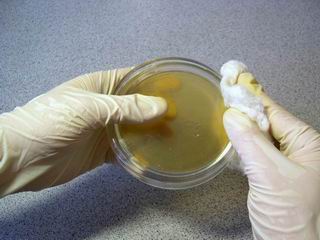
Инокуляционную петлю погружаем в спирт,

и прокаливаем ее докрасна над пламенем горелки.

Затем снова погружаем в спирт,

подносим к горелке, и тут же (пока горит спирт) несем петлю к чашке Петри.

Слегка приоткрыв крышку (не смещая ее в сторону), погружаем инокуляционную петлю в агар*.
*Это делается для того, чтобы инокуляционная петля стала липкой от оставшегося на ней расплавленного агара. (Так же, при этом происходит охлаждение инокуляционной петли до безопасной для спор температуры.)

Сразу же после этого, слегка приоткрыв пакетик с отпечатком, не касаясь его краев, соскребаем инокуляционной петлей часть спор*.
*Если отпечаток хорошего качества, достаточно едва коснуться петлей, чтобы к ней прилипли тысячи спор. Если отпечаток совсем бледный, можно основательно поскрести острым концом инокуляционной петли по бумаге, чтобы вместе с частичками бумаги наверняка захватить часть спор.

После этого, сразу же переносим инокуляционную петлю обратно к чашке Петри, и так же, слегка приоткрыв крышку (не смещая ее в сторону), касаемся поверхности агара в нескольких местах.

Если спор было достаточно много, они будут заметны на поверхности агара. Если спор было мало, на агаре останутся только следы от контакта с инокуляционной петлей. В любом случае, споры попали на питательную среду, в благоприятные условия, и через несколько дней должны прорасти.

Обязательно подписывайте свои чашки Петри (название вида, дату инокуляции и т.д., все, что считаете нужным), иначе потом Вы запутаетесь, что, где растет.

Теперь, чашки Петри необходимо обернуть пищевой пленкой. Это делается для того, чтобы предотвратить проникновение в них посторонних микроорганизмов.
Накладываем пленку поверх чашки Петри,

поднимаем чашку Петри, опуская при этом пленку

и обрезаем ее с небольшим запасом.

Теперь стягиваем края пленки вниз по всему периметру чашки Петри,
![]()
и закручиваем их (как фантик).

Закрученные края плотно прижимаем рукой

и в таком виде, убираем чашки Петри в темное, теплое (23-27С) место, на весь период инкубации.

Инкубация
Через 3-10 дней (в зависимости от количества и качества спор) споры прорастают - в местах инокуляции появляется белый пух мицелия.*
* Мицелий любого другого цвета, или консистенции, (например пленка, или слизь) является явным признаком заражения и должен быть немедленно удален.
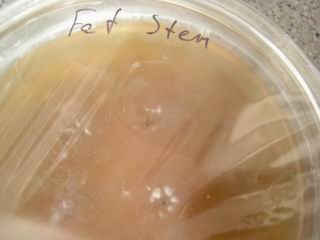
Через несколько дней, очагов мицелия становится больше, и он продолжает разрастаться.

Очаги мицелия могут появляться не только в местах, контакта с инокуляционной петлей, но и по всей поверхности агара. Это происходит потому, что пока Вы совершали манипуляции внутри чашки Петри, некоторые споры упали с инокуляционной петли сами по себе, и теперь они проросли. Так же, споры могли переместиться в результате движения жидкости (упавшие капли конденсата).

Если во время инкубационного периода, заражения среды посторонними микроорганизмами не происходит, через 3-4 недели, мицелий полностью осваивает поверхность агара.

Хранение культур
После того, как мицелий полностью освоит поверхность агара, чашки Петри убирают на хранение в холодильник. При температуре +3-5С процессы жизнедеятельности мицелия замедляются, и он может сохраняться в таких условиях несколько лет. В течение этого времени мицелий постепенно поедает питательную среду, поэтому, чем толще был ее слой, тем дольше мицелий сможет питаться.
По мере надобности, чашки Петри с мицелием достают из холодильника и отрезают кусочки агара для проведения инокуляции*, или для пересадки культуры на свежую питательную среду.**
*Для проведения инокуляции отрезают небольшой (~ 1х1 см) кусочек агара с мицелием и помещают его в емкость с субстратом. Через несколько дней мицелий перебирается на субстрат и постепенно осваивает его целиком. Фото работ по проведению инокуляции кусочками агара, можно посмотреть в иллюстрированном руководстве по выращиванию грибов.
Поскольку для проведения одной инокуляции, достаточно малюсенького кусочка агара, одной 100 мм чашки Петри, хватает на проведение 20-30 инокуляций.
**Такой метод хранения, называется "метод вегетативных пассажей" , он позволяет сохранять полученную культуру практически в неизмененном виде. Чем реже происходит пересев, тем меньше клеточных делений претерпевает культура и тем ближе она по своим свойствам к исходному изолянту. Пересадку мицелия на новую среду, в этом случае, рекомендуется проводить не чаще одного раза в год.
Для длительного хранения культур, удобно использовать пробирки со скошенным агаром. Готовую среду разливают по пробиркам, закрывают их ватно-марлевой пробкой, и после стерилизации, пока агар не застыл, устанавливают в наклонном положении - скашивают агар. После того как агар застынет, пробирки инокулируют мицелием, дожидаются полного обрастания поверхности агара, и убирают на хранение в холодильник.
Длительность хранения при этом, достигается за счет уменьшении площади роста мицелия и увеличении толщины питательного слоя (по сравнению с чашкой Петри).
Более подробную информацию о методе хранения культур в пробирках на скошенном агаре, а так же о выделении чистой культуры из плодового тела гриба, Вы сможете найти в тексте "Отечественные техники выращивания грибов в домашних условиях".
Выделение чистой культуры*
* Чистая культура - это клетки микроорганизмов одного вида. (В нашем случае, это мицелий культивируемого гриба).
Если во время роста мицелия, произошло заражение среды посторонними микроорганизмами, необходимо как можно быстрее отделить чистый мицелий, от конкурирующей микрофлоры. Это можно сделать двумя способами.
1. Удаление очага заражения
В случае "точечного заражения", (когда очаг заражения небольшой и локализован в одном месте), его проще вырезать и выбросить, оставив не тронутой основную часть мицелия.


Работы по выделению чистой культуры, должны проводиться в стерильных условиях!
Берем чашку Петри, в которой произошло заражение,

входим с ней в стерильное помещение, протираем все поверхности спиртом, погружаем скальпель в спирт, прокаливаем его над пламенем горелки, снова погружаем в спирт, подносим к горелке, и тут же (пока горит спирт), несем его к чашке Петри.*
Слегка приоткрыв крышку (не смещая ее в сторону), вырезаем скальпелем кусок агара, с растущей на нем плесенью,

подцепляем его кончиком скальпеля и удаляем.

Чашку Петри с удаленным очагом заражения оборачиваем пищевой пленкой и убираем в темное, теплое место, на весь период инкубации.*
*Смотри фото аналогичных действий при проведении инокуляции.

Если заражения посторонними микроорганизмами не произойдет, через некоторое время (зависит от того, на какой стадии роста мицелия произошло удаление очага заражения), мицелий полностью освоит поверхность агара.
2. Пересадка мицелия
В случае, когда посторонняя микрофлора занимает значительную часть, и вырезать ее не представляется возможным, из зараженной чашки Петри извлекают кусочек агара с чистым мицелием, и пересаживают его на новую среду в другую чашку Петри.

Берем чашку Петри, в которой произошло заражение, входим с ней в стерильное помещение, протираем все поверхности спиртом, погружаем скальпель в спирт, прокаливаем его над пламенем горелки, снова погружаем в спирт, подносим к горелке и тут же (пока горит спирт) несем его к чашке Петри.*
*Смотри фото аналогичных действий при работе с инокуляционной петлей.
Слегка приоткрыв крышку (не смещая ее в сторону), вырезаем скальпелем кусочек агара с чистым мицелием,

подцепляем его кончиком скальпеля

и переносим на новую среду, в другую чашку Петри.

Чашку Петри накрываем, подписываем, оборачиваем пищевой пленкой и убираем в темное, теплое место на весь период инкубации.*
*Смотри фото аналогичных действий при проведения инокуляции.

Через несколько дней, пересаженный кусочек опушится мицелием, а еще через несколько дней мицелий переберется на новую среду. Если заражения посторонними микроорганизмами не произойдет, через 3-4 недели, мицелий полностью освоит поверхность агара.
Микробиологическое исследование - это выделение чистых культур микроорганизмов, культивирование и изучение их свойств. Чистыми называют культуры, состоящие из микроорганизмов одного вида. Они нужны при диагностике инфекционных болезней, для определения видовой и типовой принадлежности микробов, в исследовательской работе, для получения продуктов жизнедеятельности микробов (токсинов, антибиотиков, вакцин и т. п.).
Для культивирования микроорганизмов (выращивание в искусственных условиях in vitro) необходимы особые субстраты - питательные среды. На средах микроорганизмы осуществляют все жизненные процессы (питаются, дышат, размножаются и т. д.), поэтому их еще называют средами для культивирования.
Питательные среды
Питательные среды являются основой микробиологической работы, и их качество нередко определяет результаты всего исследования. Среды должны создавать оптимальные (наилучшие) условия для жизнедеятельности микробов.
Требования, предъявляемые к средам
Среды должны соответствовать следующим требованиям:
1) быть питательными, т. е. содержать в легко усвояемом виде все вещества, необходимые для удовлетворения пищевых и энергетических потребностей. Ими являются источники органогенов и минеральных (неорганических) веществ, включая микроэлементы. Минеральные вещества не только входят в структуру клетки и активизируют ферменты, но и определяют физико-химические свойства сред (осмотическое давление, рН и др.). При культивировании ряда микроорганизмов в среды вносят факторы роста - витамины, некоторые аминокислоты, которые клетка не может синтезировать;
Внимание! Микроорганизмы, как все живые существа, нуждаются в большом количестве воды.
2) иметь оптимальную концентрацию водородных ионов - рН, так как только при оптимальной реакции среды, влияющей на проницаемость оболочки, микроорганизмы могут усваивать питательные вещества.
Для большинства патогенных бактерий оптимальна слабощелочная среда (рН 7,2-7,4). Исключение составляют холерный вибрион - его оптимум находится в щелочной зоне (рН 8,5-9,0) и возбудитель туберкулеза, нуждающийся в слабокислой реакции (рН 6,2-6,8).
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили рН, среды должны обладать буферностью, т. е. содержать вещества, нейтрализующие продукты; обмена;
3) быть изотоничными для микробной клетки; т. е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальна среда, соответствующая 0,5% раствору натрия хлорида;
4) быть стерильными, так как посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды (состав, рН и др.);
5) плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию;
6) обладать определенным окислительно-восстановительным потенциалом, т. е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH 2 . Этот потенциал показывает насыщение среды кислородом. Для одних микроорганизмов нужен высокий потенциал, для других - низкий. Например, анаэробы размножаются при RH 2 не выше 5, а аэробы - при RH 2 не ниже 10. Окислительно-восстановительный потенциал большинства сред удовлетворяет требованиям к нему аэробов и факультативных анаэробов;
7) быть по возможности унифицированным, т. е. содержать постоянные количества отдельных ингредиентов. Так, среды для культивирования большинства патогенных бактерий должны содержать 0,8-1,2 г/л аминного азота NH 2 , т. е. суммарного азота аминогрупп аминокислот и низших полипептидов; 2,5-3,0 г/л общего азота N; 0,5% хлоридов в пересчете на натрия хлорид; 1% пептона.
Желательно, чтобы среды были прозрачными - удобнее следить за ростом культур, легче заметить загрязнение среды посторонними микроорганизмами.
Классификация сред
Потребность в питательных веществах и свойствах среды у разных видов микроорганизмов неодинакова. Это исключает возможность создания универсальной среды. Кроме того, на выбор той или иной среды влияют цели исследования.
В настоящее время предложено огромное количество сред* в основу классификации которых положены следующие признаки.
1. Исходные компоненты . По исходным компонентам различают натуральные и синтетические среды. Натуральные среды готовят из продуктов животного и растительного происхождения. В настоящее; время разработаны среды, в которых ценные пищевые продукты (мясо и др.) заменены непищевыми: костной и рыбной мукой, кормовыми дрожжами, сгустками крови и др. Несмотря на то что состав питательных сред из натуральных продуктов очень сложен и меняется в зависимости от исходного сырья, эти среды нашли широкое применение. Синтетические среды готовят из определенных химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворенных в дважды дистиллированной воде. Важное преимущество этих сред в том, что состав их постоянен (известно, сколько и какие вещества в них входят), поэтому эти среды легко воспроизводимы.
2. Консистенция (степень плотности). Среды бывают жидкие, плотные и полужидкие. Плотные и полужидкие среды готовят из жидких, к которым для получения среды нужной консистенции прибавляют обычно агар-агар или желатин.
Агар-агар - полисахарид, получаемый из определенных сортов морских водорослей. Он не является для микроорганизмов питательным веществом и служит только для уплотнения среды. В воде агар плавится при 80-100° С, застывает при 40-45° С.
Желатин - белок животного происхождения. При 25-30° С желатиновые среды плавятся, поэтому культуры на них обычно выращивают при комнатной температуре. Плотность этих сред при рН ниже 6,0 и выше 7,0 уменьшается, и они плохо застывают. Некоторые микроорганизмы используют желатин как питательное вещество - при их росте среда разжижается.
Кроме того, в качестве плотных сред применяют свернутую сыворотку крови, свернутые яйца, картофель, среды с селикагелем.
3. Состав . Среды делят на простые и сложные. К первым относят мясопептонный бульон (МПБ), мясопептонный агар (МПА), бульон и агар Хоттингера, питательный желатин и пептонную воду. Сложные среды готовят, прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества, необходимые для размножения того или иного микроорганизма.
4. Назначение : а) основные (общеупотребительные) среды служат для культивирования большинства патогенных микробов. Это вышеупомянутые МПА, МПБ, бульон и агар Хоттингера, пептонная вода;
б) специальные среды служат для выделения и выращивания микроорганизмов, не растущих на простых средах. Например, для культивирования стрептококка к средам прибавляют сахар, для пневмо- и менингококков - сыворотку крови, для возбудителя коклюша - кровь;
в) элективные (избирательные) среды служат для выделения определенного вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Так, соли желчных кислот, подавляя рост кишечной палочки, делают среду элективной для возбудителя брюшного тифа. Среды становятся элективными при добавлении к ним определенных антибиотиков, солей, изменении рН.
Жидкие элективные среды называют средами накопления. Примером такой среды служит пептонная вода с рН 8,0. При таком рН на ней активно размножается холерный вибрион, а другие микроорганизмы не растут;
г) дифференциально-диагностические среды позволяют отличить (дифференцировать) один вид микробов от другого по ферментативной активности, например среды Гисса с углеводами и индикатором. При росте микроорганизмов, расщепляющих углеводы, изменяется цвет среды;
д) консервирующие среды предназначены для первичного посева и транспортировки исследуемого материала; в них предотвращается отмирание патогенных микроорганизмов и подавляется развитие сапрофитов. Пример такой среды - глицериновая смесь, используемая для сбора испражнений при исследованиях, проводимых с целью обнаружения ряда кишечных бактерий.
Рецепты приготовления некоторых сред приведены в конце следующего раздела и во второй части учебника.
Контрольные вопросы
1. Каким требованиям должны удовлетворять питательные среды?
2. Как классифицируют среды по исходным компонентам?
3. Какие вещества служат для уплотнения сред?
4. Какие среды являются простыми или общеупотребительными и для чего их применяют?
5. Какие среды называют сложными, что служит их основой?
6. Какие среды позволяют получить преимущественный рост одних микробов при одновременном подавлении других?
7. На каких средах изучают ферментативную активность микробов?
Задание
Заполните форму, указав на какие группы подразделяют среды.
Приготовление сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла, или окислов железа, которые могут попасть в среду при варке ее в ржавых кастрюлях. Лучше всего пользоваться стеклянной, эмалированной или алюминиевой посудой. Большие количества среды (десятки и сотни литров) готовят в специальных варочных котлах или реакторах (рис. 14). Перед употреблением посуду необходимо тщательно вымыть, прополоскать и высушить. Новую стеклянную посуду предварительно кипятят 30 мин в 1-2% растворе хлороводородной кислоты или погружают в этот раствор на ночь, после чего в течение часа прополаскивают в проточной воде.
Внимание! Посудой, предназначенной для приготовления сред, нельзя пользоваться в других целях, например для хранения химических реактивов или дезинфицирующих растворов - даже следы этих веществ могут помешать росту микроорганизмов.
Исходным сырьем для приготовления большинства сред служат продукты животного или растительного происхождения: мясо и его заменители, молоко, яйца, картофель, соя, кукуруза, дрожжи и др.
Основные питательные бульоны готовят на мясной воде или на различных переварах, полученных при кислотном или ферментативном гидролизе исходного сырья. Бульоны из переваров в 5-10 раз экономичнее, чем из мясной воды. Среды на переварах богаче аминокислотами, следовательно, питательнее; обладают большей буферностью, т. е. имеют более стабильную величину рН. Кроме того, перевары можно готовить из заменителей мяса (сгустков крови, плаценты, казеина и т. д.).
В настоящее время снабжение лабораторий мясной водой и переварами централизованно. Чаще пользуются панкреатическим переваром Хоттингера, гидролизатами казеина или кормовых дрожжей. Из этих полуфабрикатов по определенным рецептам готовят необходимые среды.
Этапы приготовления сред: 1) варка; 2) установление оптимальной величины рН; 3) осветление; 4) фильтрация; 5) разлив; 6) стерилизация; 7) контроль.
Варят среды на открытом огне, водяной бане, в автоклаве или варочных котлах, подогреваемых паром.
Установление рН сред ориентировочно производят с помощью индикаторных бумажек. Для точного определения рН пользуются потенциометром, применяя стеклянные электроды в соответствии с инструкцией или компаратором (аппарат Михаэлиса), состоящим из штатива с гнездами для пробирок (рис. 15) и набора стандартов определенного рН. При приготовлении сред пользуются обычно индикатором метанитрофенолом, изменяющим свой цвет в диапазоне 6,8-8,4.
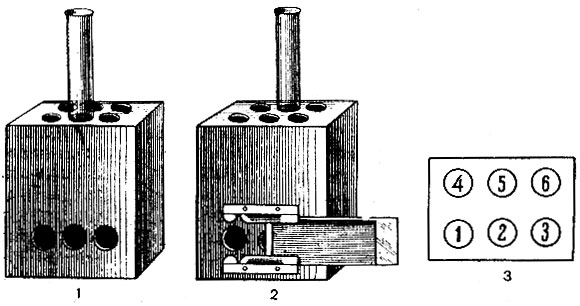
Для определения рН среды 4 пробирки, диаметр и цвет стекла которых не отличается от пробирок со стандартами, помещают в гнезда 1, 2, 3 и 5 (см. рис. 15). В 1-ю и 3-ю пробирки наливают по 5 мл дистиллированной воды; в 5-ю - 7 мл; во 2-ю - 4 мл воды и 1 мл индикатора. В гнезда 4 и 6 ставят стандарты нужного рН. В 1-ю, 2-ю и 3-ю пробирки наливают 2 мл охлажденной среды. Содержимое пробирок смешивают.
Цвет жидкостей в пробирках сравнивают в проходящем свете, закрыв заднюю прорезь прибора фильтром (матовым или синим, если жидкости интенсивно желтые). рН испытуемого раствора соответствует рН стандарта, с цветом которого совпадает его цвет.
Готовя среды с заданным рН, в гнезде 4 и 6 ставят стандарты, рН которых близок к требуемому, а во 2-ю пробирку с испытуемой средой и индикатором добавляют из бюретки определенное количество раствора щелочи, если жидкость во 2-й пробирке светлее стандартов, или раствора кислоты - если светлее стандарты. Щелочь (или кислоту) приливают до тех пор, пока цвет жидкости во 2-й пробирке не совпадает с цветом стандартов. Количество щелочи (или кислоты), прибавленное к 2 мл среды во 2-й пробирке, пересчитывают на весь объем приготовленной среды. Например, если для получения нужного рН на 2 мл среды пошло 2 капли (0,1 мл) 0,05 н. раствора щелочи, то для подщелачивания 1 л нужно в 500 раз больше, т. е. 50 мл 0,05 н. или 2,5 мл 1 н. раствора щелочи.
При стерилизации рН сред снижается на 0,2, поэтому для получения среды с рН 7,2-7,4 ее сначала готовят с рН 7,4-7,6.
Осветление сред производят, если при варке они мутнеют или темнеют. Для осветления в среду, подогретую до 50° С, вливают белок куриного яйца, взбитый с двойным количеством воды, перемешивают и кипятят. Свертываясь, белок увлекает в осадок взвешенные в среде частицы. Таким же способом можно вместо яичного белка использовать сыворотку крови (20-30 мл на 1 л среды).
Фильтрацию жидких и расплавленных желатиновых сред производят через влажный бумажный или через матерчатые фильтры. Фильтрация агаровых сред затруднена, - они быстро застывают. Обычно их фильтруют через ватно-марлевый фильтр (в воронку помещают марлевую салфетку и на нее пышный комок ваты). Можно пользоваться бумажными или матерчатыми фильтрами, если проводить фильтрацию в горячем автоклаве или в воронках с подогревом.
Фильтрацию агаровых сред можно заменить отстаиванием. Среду наливают в высокий цилиндрический сосуд и расплавляют в автоклаве. При медленном остывании среды в выключенном приборе взвешенные в ней частицы оседают на дно. На следующий день агаровый сгусток извлекают из сосуда (для этого сосуд ненадолго помещают в горячую воду) и отрезают ножом нижнюю часть со скопившимся осадком. Верхнюю часть растапливают и разливают в соответствующие емкости.
Разливают среды в пробирки (по 3-5 мл или по 10 мл), флаконы, колбы, матрацы и бутылки не более чем на 2 / 3 емкости, так как при стерилизации могут намокнуть пробки и среды утратят стерильность.
Среды, которые стерилизуют при температуре выше 100° С, разливают в чистую сухую посуду. Среды, стерилизуемые при более низкой температуре, обязательно разливают в стерильную посуду.
Разливают среды с помощью воронки, на конец которой надета резиновая трубка с зажимом Мора. Для мерного разлива применяют мензурки, бюретки, дозаторы, шприцы-пипетки и т. п. (рис. 16).

Посуду со средой обычно закрывают ватно-марлевыми пробками, поверх которых надевают бумажные колпачки. Важно, чтобы при разливе среда не смачивала края посуды, иначе к ним могут прилипнуть пробки. К каждому сосуду обязательно прикрепляют этикетку с названием среды и датой ее приготовления.
Стерилизация . Режим стерилизации зависит от состава среды и указан в ее рецепте. Примерная схема режима стерилизации сред приведена в табл. 8.

1 (Жидкие среды с углеводами, белками или витаминами лучше стерилизовать с помощью бактериальных фильтров. )
Контроль готовых сред: а) для контроля стерильности среды ставят в термостат на 2 сут, после чего просматривают. Если на средах не появятся признаки роста, их считают стерильными и передают для химического контроля по нескольку образцов каждой серии; б) химический контроль: окончательно устанавливают рН, содержание общего и аминного азота, пептона, хлоридов (их количество должно соответствовать указанному в рецепте).
Химический контроль сред производят в химической лаборатории; в) для биологического контроля несколько образцов среды засевают специально подобранными культурами микроорганизмов, и по их росту судят о питательных (ростовых) свойствах среды. К готовой среде прилагают этикетку и паспорт, в котором указывают название и состав среды, результаты контроля и др.
Хранят среды при комнатной температуре в шкафах, желательно специально для них предназначенных. Некоторые среды, например, среды с кровью и витаминами, хранят в холодильнике.
Рецепты приготовления простых (основных) сред и изотонического раствора натрия хлорида
Изотонический раствор натрия хлорида . К 1 л дистиллированной воды добавляют 9 г натрия хлорида. Раствор фильтруют, устанавливают заданный рН и, если нужно, стерилизуют при 120° С в течение 30 мин.
Мясопептонный бульон (МПБ) . К мясной воде прибавляют 1% пептона и 0,5% х. ч. натрия хлорида, кипятят на слабом огне 10-15 мин для растворения веществ, устанавливают нужный рН и снова кипятят 30-40 мин до выпадения осадка. Фильтруют, доливают до первоначального объема водой и стерилизуют 20 мин при 120° С.
Бульон Хоттинтера . Перевар Хоттингера разводят водой в 5-6 раз в зависимости от того, какое количество аминного азота он содержит и какое его количество должно быть в бульоне (указано в паспорте перевара и рецепте среды). Например, для приготовления среды с 1,2 г/л аминного азота перевар, содержащий 9,0. г/л, надо развести в 7 5 раз (9,0:1,2). К разведенному перевару прибавляют 0,5% натрия хлорида и кипятят на слабом огне до растворения соли, В остывшей среде устанавливают рН, фильтруют, разливают и стерилизуют 20 мин при
Мясопептонный агар (МПА) . К готовому бульону (до стерилизации или после нее) добавляют 2-3% измельченного агар-агара и кипятят, помешивая, на слабом огне до полного расплавления агара. МПА можно варить в автоклаве или аппарате Коха. Готовую среду, если нужно, осветляют, фильтруют и стерилизуют 20 мин при 120° С.
Полужидкий агар содержит 0,4-0,5% агар-агара .
Питательный желатин . К готовому бульону прибавляют 10-15% желатина, подогревают ДО его расплавления (не кипятят!), разливают в стерильную посуду и стерилизуют текучим паром.
Рецепты приготовления сложных сред
Среды с углеводами . К основному бульону или расплавленному агару прибавляют нужное количество (0,1-2%) определенного углевода (например, глюкозы). После его растворения разливают в стерильную посуду и стерилизуют текучим паром. Поскольку углеводы частично разрушаются даже при таком режиме стерилизации, предпочтительнее 25-30% раствор углеводов, простерилизованный через бактериальный фильтр, добавлять в нужном объеме с соблюдением асептики к стерильным основным средам - после контроля стерильности среда готова к употреблению.
Среды с кровью готовят из стерильных простых сред, добавляя в асептических условиях (лучше в боксе) от в до 30% (обычно 5%) стерильной дефибринированной крови. Агаровые среды перед этим растапливают и остужают до 45° С. Определяют температуру среды, поднося сосуд к шее у угла нижней челюсти. При нужной температуре должно быть терпимое ощущение горячего, но не ожога. После добавления крови, пока среда не застыла, содержимое сосуда тщательно перемешивают и разливают в чашки или пробирки.
Внимание! Среды с кровью растапливать нельзя - кровь изменит свои свойства.
Среды с сывороткой крови готовят так же, как среды с кровью. К основным средам добавляют 10-20% сыворотки, не содержащей консерванта и предварительно инактивированной при 56° С в течение 30 мин на водяной бане или в инактиваторе. При инактивации разрушается вещество (комплемент), губительно действующее на микробы.
Среды с желчью . К простым средам добавляют желчь в количестве 10-40% объема среды, устанавливают нужный рН и стерилизуют 20 мин при 120° С. Можно стерильную желчь добавить к стерильной среде в асептических условиях.
Разлив агаровых сред в чашки Петри . Среды перед разливом расплавляют на водяной бане и остужают до 45-50° С. Обычно для чашки диаметром 9 см достаточно 15-20 мл среды (высота слоя 0,25-0,3 см). Если слой выше, на нем менее контрастно выглядят колонии. При очень тонком слое резко ограничено количество питательных веществ и влаги (среда быстро высыхает) - ухудшаются условия культивирования.
Разливают среды в стерильные чашки в асептических условиях. Чашки ставят крышкой вверх. Сосуд со средой берут в правую руку, держа его у огня. Левой рукой вынимают пробку, зажав ее мизинцем и ладонью. Обжигают горлышко сосуда и двумя пальцами левой руки слегка приоткрывают крышку. Вводят под нее горлышко флакона, не прикасаясь им к краю чашки. Наливая среду, следят чтобы она равномерно распределилась по дну чашки. Если при разливе на поверхности среды образуются пузырьки воздуха, к ним до того, как среда застынет, подносят пламя спички или горелки - пузырьки лопнут. Затем чашку закрывают и дают среде застыть. Если посев производят в день разлива, среду необходимо подсушить. Для этого чашки в термостате осторожно открывают и устанавливают крышки и чашки открытой стороной вниз на 20-30 мин. Если посев производят на следующий день после разлива, чашки, не подсушивая, завертывают в ту же бумагу, в которой их стерилизовали, и помещают в холодильник.
Приготовление скошенного агара . Пробирки с 4-5 мл стерильной расплавленной агаровой среды укладывают в наклонном положении (примерно под углом 20 °) с таким расчетом, чтобы среда не заходила за 2 / 3 пробирки, иначе она может смочить пробку. После того как среда застынет, пробирки ставят вертикально - дают стечь конденсату. Лучше употреблять свежескошенный агар.
Внимание! Пользоваться средой, в которой нет конденсата, нельзя. Ее следует снова растопить на водяной бане и скосить.
Сухие среды
Отечественная промышленность выпускает сухие среды разного назначения: простые, элективные, дифференциально-диагностические, специальные. Это порошки во флаконах с завинчивающимися крышками. Хранят сухие среды в темном месте плотно закрытыми - они гигроскопичны. В лаборатории из порошков готовят среды по прописи на этикетке.
Преимущество сухих сред по сравнению со средами, изготовленными в лаборатории, - стандартность (их выпускают большими партиями), простота приготовления, делающая их доступными в любых (даже походных) условиях, стабильность, экономичность. Важно, что их можно готовить из заменителей мяса: гидролизата казеина, фибрина, кильки и даже белковых фракций микробных клеток (сарцин).
Контрольные вопросы
1. Каким должен быть рН сред для культивирования большинства патогенных микробов перед стерилизацией и почему?
2. При какой температуре плавятся и застывают агаровые среды?
3. Как должна быть подготовлена посуда, в которую разливают среды с углеводами и белками?
Задание
1. Приготовьте МПБ, МПА, бульон и агар Хоттингера с рН 7,2-7,4, разлейте во флаконы и пробирки; простерилизуйте.
2. Приготовьте из сухих порошков среды Гисса, разлейте в пробирки по 4-5 мл и простерилизуйте.
3. Приготовьте агар с кровью и разлейте его в чашки Петри.
4. Приготовьте из сухих порошков среды Эндо, ЭМС, Плоскирева и разлейте их в чашки Петри.
5. Приготовьте скошенный агар.
Методы посевов
Важным этапом бактериологического исследования является посев. В зависимости от цели исследования, характера посевного материала и среды используют разные методы посева. Все они включают обязательную Цель: оградить посев от посторонних микробов. Поэтому работать следует быстро, но без резких движений, усиливающих колебания воздуха. Во время посевов нельзя разговаривать. Посевы лучше делать в боксе.
Внимание! Не забывайте выполнять правила личной безопасности при работе с заразным материалом.
Посев из пробирки в пробирку . Пробирку с посевным материалом и пробирку со средой держат слегка наклонно в левой руке между большим и указательным пальцами так, чтобы края пробирок были на одном уровне, а их основания находились поверх кисти. Обычно пробирку с посевным материалом держат ближе к себе. В правой руке, как писчее перо, держат бактериальную петлю, и стерилизуют ее, держа вертикально в пламени горелки. Мизинцем и краем ладони правой руки вынимают обе пробки одновременно. Извлекают пробки не рывком, а плавно - легкими винтовыми движениями. Вынув пробки, края пробирок обжигают в пламени горелки. Прокаленную петлю вводят через пламя горелки в пробирку с посевным материалом, охлаждают и, набрав немного материала, осторожно переносят в пробирку со средой.
При посеве в жидкую среду посевной материал растирают на стенке пробирки над жидкостью и смывают средой.
При посеве на жидкие среды тампоном его погружают в среду и 3-5 с ополаскивают в ней. При посеве на плотную среду материал втирают в ее поверхность, вращая тампон, после чего тампон обеззараживают (помещают в пробирку, в которой он был доставлен в лабораторию, и автоклавируют).
Внимание! Следите, чтобы среда не вылилась и не смочила пробку.
При посеве на скошенный агар материал обычно растирают на поверхности среды зигзагообразными движениями снизу вверх, начиная от границы конденсата.
При посеве на плотные среды, разлитые в пробирки столбиком, петлей с посевным материалом прокалывают столбик, производя так называемый посев "уколом".
После посева петлю извлекают из пробирки, края пробирок обжигают и, проведя пробки через пламя горелки, закрывают пробирки, после чего прокаливают петлю.
Посев жидкого материала можно производить стерильными пипетками (пастеровскими или градуированными). После посева пипетки погружают в дезинфицирующую жидкость.
Посевы во флаконы, матрацы и бутыли производят примерно так, как в пробирки, только сначала набирают материал (петлей или в пипетку), а потом открывают сосуд со средой.
Сосуды с засеянной культурой надписывают и ставят в термостат.
Посев на пробирки с чашки Петри . Изучив характер роста культуры на чашке, со стороны дна отмечают восковым карандашом нужный для посева участок. Чашку с посевным материалом ставят перед собой крышкой вверх. Левой рукой приоткрывают крышку и вводят под нее обожженную петлю. Остудив петлю, набирают посевной, материал с отмеченного участка. Вынимают петлю, закрывают чашку и в левую руку берут пробирку со средой. Посев производят так же, как с пробирки в пробирку. После посева чашку поворачивают вверх дном.
Посев на агар в чашки Петри . Посев шпателем. Шпатель - это стеклянная или металлическая трубочка, конец которой загнут в виде треугольника. Шпатель можно сделать из пастеровской пипетки, согнув под углом ее тонкий конец, предварительно разогретый в пламени горелки.
Левой рукой слегка приоткрывают крышку, держа ее большим и указательным пальцем. Петлей, пипеткой или стеклянной палочкой наносят на поверхность среды посевной материал, после чего тщательно втирают его круговыми движениями шпателя до тех пор, пока шпатель не перестанет свободно скользить по поверхности среды, левой рукой при этом придерживают крышку и одновременно вращают чашку. По окончании посева шпатель вынимают из чашки и закрывают крышку. Стеклянный шпатель помещают в дезинфицирующий раствор, а металлический прокаливают в пламени горелки.
Посев петлей. Небольшое количество посевного материала (иногда его предварительно эмульгируют в стерильном изотоническом растворе или бульоне) втирают петлей в поверхность среды у края чашки, несколько раз проводя петлей из стороны в сторону. Затем у того места, где закончились штрихи, агар прокалывают петлей, снимая избыток посевного материала. Оставшийся на петле посевной материал зигзагообразными движениями распределяют по всей поверхности среды. По окончании посева закрывают чашку и прожигают петлю.
Посев петлей на секторы. Чашку со стороны дна расчерчивают на секторы. Посев производят зигзагообразными движениями от края чашки к центру. Необходимо следить, чтобы штрихи не заходили на соседний сектор.
Посев тампоном. Тампон с посевным материалом вносят в слегка приоткрытую чашку и круговыми движениями втирают его содержимое в поверхность среды, вращая при этом тампон и чашку.
Посев газоном. Примерно 1 мл (20 капель) жидкой культуры (если культура с плотной среды, ее эмульгируют в стерильном изотоническом растворе или бульоне) наносят на поверхность агара и тщательно распределяют жидкость по поверхности среды. Чашку слегка наклоняют и пипеткой отсасывают избыток культуры, выливая ее в дезинфицирующий раствор. Туда же помещают пипетку.
Посев в толщу агара. Культуру, выращенную на жидкой среде, или эмульгированный материал вносят в сосуд с расплавленным и остуженным до 45° С агаром, перемешивают и выливают в стерильную чашку Петри. Можно внести посевной материал в пустую чашку и залить 15-20 мл остуженного до 45° С агара. Для перемешивания содержимого чашки ее слегка покачивают и вращают. Чашки оставляют на столе до застывания среды.
Засеянные чашки подписывают со стороны дна и помещают в термостат дном вверх.
Контрольные вопросы
1. Нужны ли асептические условия во время посева? Обоснуйте ответ.
2. Как нужно обработать рабочее место по окончании посевов?
Методы культивирования
Для успешного культивирования, помимо правильно подобранных сред и правильно произведенного посева, необходимы оптимальные условия: температура, влажность, аэрация (снабжение воздухом). Как правило, подходящие условия удается создать, тщательно воспроизведя условия природной обстановки.
Температура . Оптимальную температуру для культивирования большинства патогенных микроорганизмов (37° С) создают в термостате (рис. 17). Это прибор с двойными стенками, между которыми находится воздух или вода, подогреваемые электричеством. Он снабжен терморегулятором, автоматически поддерживающим нужную температуру, и термометром для контроля за температурой.
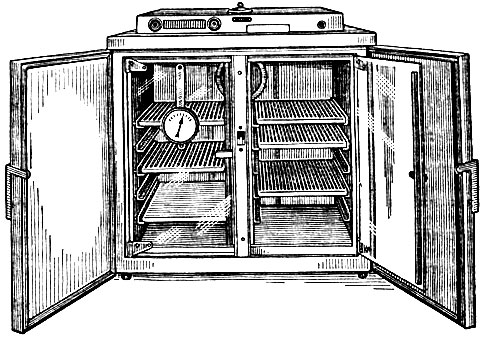
Пробирки с посевами в штативах, проволочных сетках или банках устанавливают на полках термостата. Чашки в термостате должны стоять вверх дном. Чтобы воздух в термостате свободно циркулировал и нагрев был равномерным, полки в термостате делают с прорезями и плотно не загружают. Чтобы не охладить культуры, термостат не оставляют надолго открытым.
Лаборант обязан ежедневно регистрировать температуру в термостате и поддерживать чистоту в приборе, а при неисправности вызвать мастера.
Свет подавляющему большинству микробов (к ним относятся все патогенные) не нужен - их культивируют в темноте. Однако для изучения пигментообразования, которое происходит активнее на рассеянном свету, культуры после термостата выдерживают 2-3 дня при комнатном освещении.
Внимание! Следует избегать попадания прямых солнечных лучей, действующих на культуры губительно.
Влажность . Жизнь микробов невозможна без влаги - питательные вещества проникают в клетку только в растворенном виде. Это необходимо учитывать при культивировании на плотных средах: разливать их в чашки и скашивать в пробирках лучше в день посева. При культивировании микробов, особенно чувствительных к отсутствию влаги, например гонококков, в термостат ставят открытый сосуд с водой.
Сроки культивирования . Большинство патогенных микробов культивируют 18-24 ч, но есть виды, растущие медленно (до 4-6 нед). Чтобы сохранить в них влагу, ватные пробки после посева заменяют стерильными резиновыми или надевают на них резиновые колпачки.
Внимание! Резиновые пробки стерилизуют в автоклаве завернутыми в бумагу.
Аэрация . По потребности микробов в свободном кислороде их делят на аэробы и анаэробы. Обе группы требуют различных условий культивирования.
Поступление кислорода, необходимого для культивирования аэробов и факультативных анаэробов, осуществляется при пассивной и активной аэрации.
Пассивная аэрация - это культивирование на плотных и жидких средах в сосудах, закрытых ватными или ватно-марлевыми пробками, или в чашках Петри. При таком культивировании микробы потребляют кислород, растворенный в среде, находящийся в сосуде над средой и поступающий через пробку. Пассивно аэрируемые культуры можно выращивать на поверхности или в тонком слое среды, куда проникает кислород воздуха.
Активную аэрацию применяют при глубинном культивировании микробов, когда их выращивают в больших объемах среды. Чтобы достаточно снабдить кислородом такие культуры, их помещают в специальные качалки - постоянное перемешивание культуры обеспечивает соприкосновение ее с воздухом. При культивировании в объемах жидкости, достигающих десятков и сотен литров, проводимом в приборах, называемых реакторами или ферментерами, воздух продувают через культуру при помощи специальных устройств.
Культивирование анаэробов сложнее, чем аэробов, так как их необходимо лишить доступа свободного кислорода воздуха. Для этого удаляют воздух из питательной среды различными способами.
Культивирование актиномицетов, грибов, микоплазм, L-форм, спирохет и простейших . Культивирование этих микроорганизмов принципиально сходно с культивированием бактерий. Для них разработаны специальные среды и подобраны режимы, соответствующие их потребностям.
Чистой культурой называют скопление микробов одного вида на плотной или в жидкой питательной среде.
Существует ряд методов выделения чистой культуры в зависимости от свойств изучаемого материала и цели исследования. Обычно чистые культуры получают из изолированных колоний - обособленных скоплений микробов на плотной среде. Считают, что чаще всего колония развивается из одной микробной клетки, т. е. является чистой культурой этого микроорганизма.
Этапы выделения чистой культуры:
1-й день - получение изолированных колоний. Каплю исследуемого материала петлей, пипеткой или стеклянной палочной наносят на поверхность агара в чашке Петри. Шпателем втирают материал в поверхность среды; не прожигая и не перевертывая шпателя, производят посев на 2-й, а затем на 3-й чашке. При таком посеве на 1-ю чашку приходится много материала и соответственно много микробов, на 2-ю меньше и на 3-ю еще меньше.
Можно получить изолированные колонии при посеве петлей. Для этого исследуемый материал эмульгируют в бульоне или изотоническом растворе натрия хлорида.
2-й день - изучают рост микробов на чашках. В 1-й чашке обычно бывает сплошной рост - выделить изолированную колонию не удается. На поверхности агара во 2-й и 3-й чашке вырастают изолированные колонии. Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда в стереоскопическом микроскопе (см. главу 31). Нужную колонию отмечают со стороны дна чашки и пересевают на скошенный агар. Посевы ставят в термостат.
Внимание! Пересевать можно только изолированные колонии.
3-й день - изучают характер роста на скошенном агаре. Делают мазок, окрашивают его и, убедившись в том, что культура чистая, приступают к ее изучению. На этом выделение чистой культуры заканчивается. Выделенная из определенного источника и изученная культура, называется штаммом.
При выделении чистой культуры из крови (гемокультуры) ее предварительно "подращивают" в жидкой среде: 10-15 мл стерильно взятой крови засевают в 100-150 мл жидкой среды. Так поступают потому, что в крови обычно мало микробов. Соотношение засеваемой крови и питательной среды 1:10 не случайно - так достигается разведение крови (неразведенная кровь губительно действует на микроорганизмы). Колбы с посевом ставят в термостат. Через сутки (иногда через большее время в зависимости от выделяемой культуры) из содержимого колб делают высевы на чашки для получения изолированных колоний. При необходимости повторяют высевы с интервалами 2-3 дня.
При выделении чистой культуры из мочи, промывных вод желудка и других жидкостей их предварительно центрифугируют в асептических условиях и засевают осадок. Дальнейшее выделение чистой культуры производят обычным способом.
Для выделения чистой культуры широко применяют элективные среды.
В ряде методов для получения чистых культур используют биологические особенности выделяемого микроба. Например, при выделении спорообразующих бактерий посевы прогревают при 80° С 10 мин, убивая этим вегетативные формы; при выделении возбудителя туберкулеза, устойчивого к кислотам и щелочам, с помощью этих веществ посевной материал освобождают от сопутствующей флоры; для выделения пневмококка и палочки чумы исследуемый материал вводят белым мышам - в их организме, высокочувствительном к данным возбудителям, эти микробы размножаются быстрее других.
В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из одной клетки. Такая культура называется клон. Для ее получения чаще всего пользуются микроманипулятором - прибором, снабженным инструментами (иглами, пипетками) микроскопических размеров. С помощью держателя под контролем микроскопа их вводят в препарат "висячая капля", извлекают нужную клетку (одну) и переносят ее в питательную среду.
Изучение выделенных культур
Изучение морфологии, подвижности, тинкториальных свойств (см. главу 3), характера роста на средах (культуральные свойства), ферментативной активности и ряда других особенностей выделенного микроба позволяет установить его таксономическое положение, т. е. классифицировать микроорганизм: определить его род, вид, тип, подтип, разновидность. Это называется идентификацией. Идентификация микроорганизмов очень важна при диагностике инфекций, установлении источников и путей ее передачи и в ряде других научно-практических исследований.
Культуральные свойства
Разные виды микроорганизмов по-разному растут на средах. Эти различия служат для их дифференциации. Одни хорошо растут на простых средах, другие - требовательны и растут только на специальных. Микроорганизмы могут давать обильный (пышный) рост, умеренный или скудный. Культуры могут быть бесцветными, сероватыми, серо-голубыми. Культуры микроорганизмов, образующих пигмент, имеют разнообразную окраску: белую, желтую или золотистую у стафилококка, красную - у чудесной палочки, сине-зеленую - у сине-зеленой палочки, пигмент которой, растворимый в воде, окрашивает не только колонии, но и среду.
На плотных средах микроорганизмы в зависимости от количества посевного материала образуют или сплошной налет ("газон"), или изолированные колонии. Культуры бывают грубые и нежные, прозрачные и непрозрачные, с поверхностью матовой, блестящей, гладкой, шероховатой, сухой, бугристой.
Колонии могут быть крупные (4-5 мм в диаметре и больше), средние (2-4 мм), мелкие (1-2 мм) и карликовые (меньше 1 мм). Они различаются по форме, расположению на поверхности среды (выпуклые, плоские, куполообразные, вдавленные, круглые, розеткообразные), форме краев (ровные, волнистые, изрезанные).
В жидких средах микроорганизмы могут образовывать равномерную муть, давать осадок (зернистый, пылевидный, хлопьевидный) или пленку (нежную, грубую, морщинистую).
На полужидких средах при посеве уколом подвижные микробы вызывают помутнение толщи среды, неподвижные - растут только по "уколу", оставляя остальную среду прозрачной.
Культуральные свойства определяют, изучая характер роста культуры простым глазом, с помощью лупы, под малым увеличением микроскопа или пользуясь стереоскопическим микроскопом. Величину и форму колоний, форму краев и прозрачность изучают в проходящем свете, рассматривая чашки со стороны дна. В отраженном свете (со стороны крышки) определяют характер поверхности, окраску. Консистенцию определяют прикосновением петли.
Морфологические свойства
Изучение морфологии микробов тоже служит для их дифференциации. Морфологию изучают в окрашенных препаратах. Устанавливают форму и величину клеток, их расположение в препарате, наличие спор, капсул, жгутиков. В окрашенных препаратах определяют отношение микробов к краскам (тинкториальные свойства) - хорошо или плохо воспринимают краски, как относится к дифференциальным окраскам (в какой цвет окрашивается по Граму, Цилю - Нильсену и др.). Витальная (прижизненная) окраска позволяет установить подвижность, отдифференцировать живые и мертвые клетки, следить за их делением. Деление и подвижность можно изучать в нативных (неокрашенных) препаратах (см. главу 3).
Ферментативная активность
Ферментативная активность микроорганизмов богата и разнообразна. По ней можно установить не только видовую и типовую принадлежность микроба, но и определить его варианты (так называемые биовары). Рассмотрим основные ферментативные свойства и их качественное определение.
Расщепление углеводов (сахаролитическая активность), т. е. способность расщеплять сахара и многоатомные спирты с образованием кислоты или кислоты и газа, изучают на средах Гисса, которые содержат тот или иной углевод и индикатор. Под действием образующейся при расщеплении углевода кислоты индикатор изменяет окраску среды. Поэтому эти среды названы "пестрый ряд". Микробы, не ферментирующие данный углевод, растут на среде, не изменяя ее. Наличие газа устанавливают по образованию пузырьков в средах с агаром или по скоплению его в "поплавке" на жидких средах. "Поплавок" - узкая стеклянная трубочка с запаянным концом, обращенным вверх, которую до стерилизации помещают в пробирку со средой (рис. 18).

Рис. 18. Изучение сахаролитической активности микроорганизмов. I - "пестрый ряд": а - жидкая среда с углеводами и индикатором Андреде; б - полужидкая среда с индикатором ВР: 1 - микроорганизмы не ферментируют углевод; 2 - микроорганизмы ферментируют углевод с образованием кислоты; 3 - микроорганизмы ферментируют углевод с образованием кислоты и газа; II - колонии микроорганизмов, не разлагающих (бесцветные) и разлагающих лактозу (фиолетовые на среде ЭМС - слева, красные на среде Эндо - справа)
Кроме того, сахаролитическую активность изучают на средах Эндо, ЭМС, Плоскирева. Микроорганизмы, сбраживая до кислоты находящийся в этих средах молочный сахар (лактозу), образуют окрашенные колонии - кислота изменяет цвет имеющегося в среде индикатора. Колонии микробов, не ферментирующих лактозу, бесцветны (см. рис. 18).
Молоко при росте микробов, сбраживающих лактозу, свертывается.
При росте микроорганизмов, образующих амилазу, на средах с растворимым крахмалом происходит его расщепление. Об этом узнают, прибавив к культуре несколько капель раствора Люголя - цвет среды не изменяется. Нерасщепленный крахмал дает с этим раствором синее окрашивание.
Протеолитические свойства (т. е. способность расщеплять белки, полипептиды и т. п.) изучают на средах с желатином, молоком, сывороткой, пептоном. При росте на желатиновой среде микробов, ферментирующих желатин, среда разжижается. Характер разжижения, вызываемый разными микробами, различен (рис. 19). Микробы, расщепляющие казеин (молочный белок), вызывают пептонизацию молока - оно приобретает вид молочной сыворотки. При расщеплении пептонов могут выделяться индол, сероводород, аммиак. Их образование устанавливают с помощью индикаторных бумажек. Фильтровальную бумагу заранее пропитывают определенными растворами, высушивают, нарезают узенькими полосками длиной 5-6 см и после посева культуры на МПБ помещают под пробку между нею и стенкой пробирки. После инкубации в термостате учитывают результат. Аммиак вызывает посинение лакмусовой бумажки; при выделении сероводорода на бумажке, пропитанной 20% раствором свинца ацетата и натрия гидрокарбоната, происходит образование свинца сульфата - бумажка чернеет; индол вызывает покраснение бумажки, пропитанной раствором щавелевой кислоты (см. рис. 19).

Помимо указанных сред, способность микроорганизмов расщеплять различные питательные субстраты определяют с помощью бумажных дисков, пропитанных определенными реактивами (системы индикаторные бумажные "СИБ"). Эти диски опускают в пробирки с исследуемой культурой и уже через 3 ч инкубации в термостате при 37° С по изменению цвета дисков судят о разложении углеводов, аминокислот, белков и т. д.
Гемолитические свойства (способность разрушать эритроциты) изучают на средах с кровью. Жидкие среды при этом становятся прозрачными, а на плотных средах вокруг колонии появляется прозрачная зона (рис. 20). При образовании метгемоглобина среда зеленеет.

Сохранение культур
Выделенные и изученные культуры (штаммы), представляющие ценность для науки или производства, хранят в музеях живых культур. Общесоюзный музей находится в Государственном НИИ стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича (ГИСК).
Задача хранения - поддержать жизнеспособность микроорганизмов и предупредить их изменчивость. Для этого надо ослабить или прекратить обмен в микробной клетке.
Один из самых совершенных методов длительного сохранения культур - лиофилизация - высушивание в вакууме из замороженного состояния позволяет создать состояние анабиоза. Высушивание проводят в специальных аппаратах. Хранят культуры в запаянных ампулах при температуре 4° С, лучше при -30-70° С.
Восстановление высушенных культур. Сильно нагревают кончик ампулы в пламени горелки и прикасаются к нему ватным тампоном, слегка * смоченным холодной водой, чтобы на стекле образовались микротрещины, через которые воздух медленно просочится внутрь ампулы. При этом, проходя через разогретые края трещин, воздух стерилизуется.
* (При избытке воды на тампоне она может попасть в ампулу и нарушить стерильность культуры: ее засосет через образовавшиеся микротрещины, так как в ампуле вакуум. )
Внимание! Не забывайте, что в запаянной ампуле вакуум. Если воздух в нее попадает сразу через большое отверстие, может распылиться находящаяся в ампуле культура и произойти ее выброс.
Дав войти воздуху, быстро пинцетом надламывают и удаляют верхушку ампулы. Слегка обжигают отверстие и стерильной пастеровской пипеткой или шприцем вносят в ампулу растворитель (бульон или изотонический раствор). Перемешивают содержимое ампулы и засевают на среды. Рост восстановленных культур в первых посевах может быть замедлен.
Длительно сохранять культуры можно также в жидком азоте (-196° С) в специальных приборах.
Методы непродолжительного сохранения культур следующие: 1) субкультивирование (периодические пересевы на свежие среды) с интервалами, зависящими от свойств микроорганизма, среды и условий культивирования. Между пересевами культуры хранят при 4° С; 2) сохранение под слоем масла. Культуру выращивают в агаре столбиком высотой 5-6 см, заливают стерильным вазелиновым маслом (слой масла примерно 2 см) и хранят вертикально в холодильнике. Сроки хранения у разных микроорганизмов разные, поэтому из пробирок периодически высевают культуру, чтобы проверить ее жизнеспособность; 3) хранение при -20-70° С; 4) хранение в запаянных пробирках. По мере надобности сохраняемый материал высевают на свежую среду.
Контрольные вопросы
1. Что входит в понятие "бактериологическое исследование"?
2. Какой должна быть культура для такого исследования?
3. Что такое колония микробов, культура, штамм, клон?
4. Что входит в понятие "культуральные свойства микробов"?
Задание
1. Изучите и опишите несколько колоний. Пересейте их на скошенный агар и на сектор.
2. Изучите и опишите характер роста - культуры на скошенном агаре. Определите чистоту и морфологию культуры в окрашенном препарате.
3. Пересейте культуру со скошенного агара на бульон и на дифференциально-диагностические среды. Изучите и запишите в протокол характер роста культуры на этих средах и ее ферментативные свойства.
Подготовьте чашки Петри. Вы их видели - небольшие плоские чашки из стекла или прозрачного пластика. У чашек Петри есть две части, верхняя и нижняя, они вставляются друг в друга, что служит для защиты культуры микроорганизмов от воздуха и прочих потенциальных источников заражения, а также сдерживает газы, выделяемые микроорганизмами в ходе фазы роста. Чашки Петри должны быть стерильны. Стерильны! Иначе результаты эксперимента по выращиванию бактерий пойдут насмарку. Если вы покупаете чашки Петри, то они должны продаваться в герметично запакованной упаковке (такие чашки предварительно простерилизованы холодным методом). Достаньте чашки из упаковки и разделите половинки. Очень аккуратно залейте питательную среду в нижнюю половинку чашки тонким слоем, только лишь покрывающим дно. Быстро закройте чашку Петри, чтобы не допустить попадания в агар бактерий из воздуха. Дайте чашкам Петри спокойно постоять минут 30-120, пока питательная среда на остынет и не затвердеет (готовая питательная среда будет напоминать желе).

Подсадите культуру бактерий в чашку Петри. Агар тверд, чашка Петри комнатной температуры - все готово к продолжению эксперимента! А что дальше по плану? Правильно, подсадка культуры бактерий в питательную среду! И тут есть два метода - либо прямой контакт, либо отбор образцов. Прямой контакт: в этом случае бактерии попадают на агар через… да, через прямой с ним контакт. Один из самых распространенных методов проведения подсадки таким образом - это просто легонько коснуться пальцем поверхности питательной среды (до или после мытья рук - неважно). Как вариант, можно коснуться ногтем или даже старой монеткой. Можно просто поместить на питательной среде волосок или капнуть туда капельку молока. В общем, используйте воображение! Отбор образцов: этот метод позволит вам провести забор образцов микроорганизмов с любой поверхности и перенести их в питательную среду. Все, что потребуется - ватные палочки. Просто проведите палочкой там, откуда вы хотите взять образец микрофлоры (хоть изо рта, хоть с клавиатуры), затем проведите тем же концом палочки по поверхности питательной среды (не порвите ее). Через пару дней вы увидите интересные и ужасные результаты своего эксперимента! Как вариант, в чашку Петри можно подсаживать микроорганизмы из разных источников - для этого просто надо разделить чашку на четвертинки.

Закройте, подпишите и запечатайте чашки Петри. Поместив бактерии на питательную среду, вам нужно закрыть чашку крышкой и запечатать ее чем-то вроде скотча. Обязательно подпишите, что и откуда растет в каждой конкретной чашке, иначе потом не вспомните. Писать можно маркером. В качестве меры дополнительной предосторожности, можно хранить каждую чашку в отдельном зип-пакете. Это послужит дополнительным слоем защиты для растущих бактерий. Если пакет прозрачный, то это не помешает вам разглядывать результаты.
Охладите чашки Петри. Если вы не планируете немедленно заселять бактерии в их новый дом, то чашки Петри необходимо поместить в холодильник до тех пор, пока не придет их час. Хранение чашек Петри в холодильнике является гарантией того, что вода не будет испаряться (а бактерии очень любят воду). Кроме того, питательная среда на холоде станет еще чуть тверже, а это не даст вам случайно порвать ее во время подсадки бактерий. Хранить чашки Петри в холодильнике нужно вверх дном. Так на крышке не будет скапливаться конденсат, который потом будет капать обратно и портить питательную среду. Чашки Петри с питательной средой могут выдержать в холодильнике пару месяцев. Когда придет их черед, достаньте чашки из холодильника и дайте им нагреться до комнатной температуры.

Поместите чашки Петри в теплое и темное место. Скажем, на несколько дней, чтобы бактерии могли спокойно расти. И не забывайте, что хранить чашки Петри и сейчас надо кверху дном, чтобы случайные капли конденсата, падающие с крышки, не испортили красоту колонии микроорганизмов. Оптимальная температура на этом этапе - где-то между 20-37 по Цельсию. Впрочем, если нужно, чтобы микроорганизмы росли медленнее, то их всегда можно переставить в более прохладное местечко. Дайте бактериями минимум 4-6 дней на рост. За это время культура разовьется достаточно хорошо. О том, что рост начался, вас известит характерный запах, идущий от чашек Петри.

Записывайте свои результаты. Через несколько дней вы заметите, что в каждой чашке Петри густо колосится что-то свое - бактерии, плесень, грибки и т.д. Записывайте свои наблюдения за каждой чашкой, делайте выводы о том, где было больше всего бактерий. Что у вас во рту? А на дверной ручке? А на клавиатуре? Ох, результаты вас поразят… С помощью особого маркера можно отслеживать скорость роста бактерий, ежедневно рисуя контуры культуры на дне чашки Петри. Через несколько дней дно будет похоже на срез дерева - все в кругах!

Проверьте эффективность антибактериальных агентов. Интересно будет посмотреть, что будет, если добавить к культуре бактерий что-нибудь антибактериальное (мыло, к примеру). Насколько эффективным оно окажется? Ватной палочкой поместите в центр капельку чего-нибудь антибактериального, затем продолжайте эксперимент как обычно. Бактерии в чашке будут разрастаться, образовывая кольцо вокруг места, куда было нанесено антибактериальное вещество. Там бактерий не будет, это т.н. “мертвая зона”. Эффективность антибактериальных веществ можно сравнивать, оценивая ширину мертвой зоны в разных чашках Петри. Принцип прост: чем шире зона, тем эффективнее вещество.
Соблюдайте все меры предосторожности. Перед утилизаций надо позаботиться о безопасности. Да, большая часть ваших бактерий угрозы представлять не будет. Тем не менее, большие колонии бактерий могут представлять собой определенную угрозу, так что сперва их надо убить, залив хлоркой. Руки, работая с хлоркой, защитите резиновыми перчатками, глаза - очками, одежду - фартуком.

Влейте хлорку в чашки Петри. Открыв чашку, аккуратно влейте туда небольшое количество хлорки. Чашу держите в этот момент над раковиной. Контакт с хлоркой убьет бактерии. Не пролейте хлорку на кожу, она жжется. Дезинфицированные чашки Петри положите в зип-пакеты и выбросите все это в мусор.
Выращивают бактерии на желатине так. Предварительно стерилизуют пробирки, колбы и чашки Петри сухим жаром в сушильном шкафу. Затем кладут желатин небольшими кусочками в колбу с прозрачным мясным бульоном, туда же для питания бактерий добавляют еще сахар и пептон. Затем получившуюся в колбе смесь нагревают и разливают в чашки Петри или пробирки, после чего эти стеклянные чашки закрывают стеклянными крышками, а пробирки затыкают ватными пробками, чтобы туда не могли попасть бактерии, После этого вновь стерилизуют пробирки и чашки. Чтобы убить всех бактерий в питательной среде, стерилизацию проводят три дня подряд по 20 минут (дробная стерилизация).
После кипячения желатин, а вместе с ним и вся жидкость должны застыть в чашках Петри в виде горизонтальных поверхностей. Пробирки со стерилизованным желатином при охлаждении держат или вертикально, или наклонно, при этом получаются или ровные, или косые поверхности желатина. После этого прокаленной платиновой иглой, вделанной в стеклянную палочку, берут бактерии и заражают ими застывшую массу штрихом или уколом. Бактерии прививаются на питательной среде, и потом, когда чашки и пробирки с содержимым помещают в термостат, нагретый до соответствующей температуры, начинают быстро развиваться. Через некоторое время мы можем увидеть пятна на том месте, где были сделаны уколы. Таким путем можно разводить бактерии, а также сосчитать количество пятен, то есть число колоний бактерий. Потомство группы однородных бактерий, состоящее из однородных клеток и свободное от посторонних организмов, называется чистой культурой бактерий. С помощью метода чистых культур изучают отдельные виды бактерий. (Метод чистых культур используют также для выращивания микроскопически мелких грибов и водорослей.)
Выращиваются бактерии еще на агар-агаре, веществе, добываемом из бурых морских водорослей. Так же как и желатин, агар растворяют в мясном бульоне с прибавлением сахара и пептона. Методика выращивания чистых культур бактерий на агаре и желатине в основном имеет сходство. По внешней форме застывший агар напоминает прозрачный студень. Но агар плавится при температуре около 100°, а застывает при 40°, тогда как желатин застывает при температурах 22-26°. Поэтому на агаре можно получать чистые культуры бактерий, оптимальная температура жизнеспособности которых выше 26°, например 37°.
Бактерии можно культивировать еще на ломтиках картофеля и яблока, предварительно простерилизованных. Бактерии различаются по своим свойствам, а именно, одни способны разжижать желатин, другие - окрашивать его в красный, желтый, синий и другие цвета. Пигментная бактерия (Bacterium prodigiosum), иногда поселяющаяся на пшеничном хлебе, дает кроваво-красное окрашивание.
Наш краткий обзор вопросов микробиологии показывает, какое огромное значение имеют эти организмы как в круговороте веществ, совершающемся в природе, так и в практике сельскохозяйственного производства.
При разрешении многих вопросов сельского хозяйства микробиология должна играть важнейшую роль. Зараженные почвы бактериями (например, под бобовые культуры), хранение навоза, силосование, приготовление бурого сена, молочное дело и т. д. - все это связано с жизнедеятельностью бактерий.
Похожие статьи




